Stiamo vivendo una vera e propria rivoluzione tecnologica per quanto riguarda la capacità di manipolare l’informazione genetica. Una rivoluzione iniziata nel 2012-2013 quando una serie di lavori firmati da Jennifer Doudna, Emmanuelle Charpentier e Feng Zhang hanno introdotto l’uso del sistema batterico CRISPR-Cas9 per modificare sequenze specifiche tagliando il DNA per inserire la sequenza corretta. Anche se questa tecnica è applicabile solo in cellule proliferanti, ha aperto possibilità prima inimmaginabili per lo sviluppo di organismi di interesse agro-alimentare ma anche e per la terapia di malattie genetiche.
Oggi due lavori pubblicati su Nature e su Science, le due più prestigiose riviste scientifiche al mondo, hanno ulteriormente aumentato la potenzialità di modificare la sequenza fondendo il sistema CRISPR-Cas ai meccanismi di editing, ovvero a quei meccanismi che permettono di trasformare una base in un altra, ad esempio una Citosina in Uracile. In questo sistema, la funzione di CRISPR-Cas è quella di puntatore che permette di indirizzare l’attività di editing su una specifica sequenza di interesse. Grazie a questa tecnologia è possibile manipolare l’informazione genica agendo sul singolo nucleotide senza dover introdurre tagli nella molecola. In questo modo si apre la possibilità di intervenire in cellule che non stanno proliferando come quelle presenti nel cuore, nel cervello o nei muscoli, o come vedremo di modificare in modo non permanente l’informazione genetica.
Modificare singole basi delle 4 presenti nel genoma (A, C, G e T) è il sogno di chi vuol fare terapia genica per correggere mutazioni che causano malattie. Ma gli enzimi fino ad ora disponibili permettevano solo la conversione di C in T, limitando di molto le potenzialità del metodo. Alcuni ricercatori dell’Università di Harvard hanno messo a punto una nuova classe di enzimi in grado di editare la A permettendo di trasformare A in G. Per far questo i ricercatori hanno modificato un enzima che agisce sull’RNA e che trasforma A in I, una base funzionalmente equivalente alla G. Questa innovazione è stato ottenuta grazie ad un processo di ingegneria proteica effettuato all’interno delle cellule del batterio E.coli e che coinvolge successivi passaggi di evoluzione e selezione. L’enzima per fare Editing è stato poi fuso ad una versione modificata di Cas9 che non introduce tagli sul DNA ma serve solo per conferire specificità di sequenza. Il lavoro che è stato pubblicato sull’ultimo numero di Nature apre la possibilità di sviluppare nuovi approcci terapeutici per malattie genetiche come la beta talassemia.
Naturalmente, il nuovo editor non completa l’insieme delle modifiche: non è ancora possibile convertire una G in una C o una A in una T. E proprio per questo il gruppo di Liu sta lavorando allo sviluppo di nuove classi di editori di base.
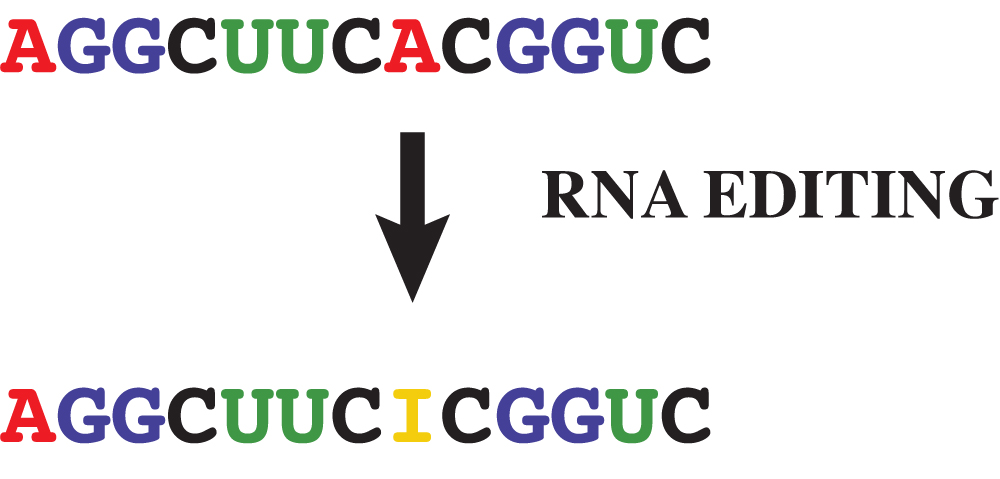
Contemporaneamente a questo lavoro, su Science il gruppo del Prof. Feng Zhang del Broad Institute al MIT ha utilizzato un approccio simile per modificare singole basi in molecole di RNA. Anche in questo caso il sistema deriva concettualmente dal sistema CRISPR-Cas9. A differenza di questo utilizza un enzima chiamato Cas13 in grado appunto di agire su RNA invece che su DNA. Permette perciò di modificare le molecole di RNA che veicolano l’informazione genetica dal DNA ai siti di sintesi delle proteine. Un mutante inattivo di Cas13 è stato fuso una un enzima in grado di modificare una specifica base. In particolare trasforma la A in I. Il sistema è stato chiamato REPAIR e offre la possibilità di modificare in modo transiente l’informazione genetica operando appunto sui trascritti genici invece che sul DNA. REPAIR, al contrario di CRISPR-Cas9, permette di modificare in modo preciso la sequenza anche in cellule non proliferanti come quelle del cuore, dei muscoli o del cervello. Inoltre, permette di ottenere cambiamenti transienti dello stato delle cellule senza modificare il loro patrimonio genico. Ad esempio, REPAIR potrebbe venir impiegato per ridurre le probabilità di rigetto in pazienti che hanno subito un trapianto. Ma gli autori propongono un utilizzo anche per trattare malattie neurodegenerative come l’Alzheimer o malattie autoimmuni ed il diabete.